Infos für Unternehmen über Kosmetik
Kosmetische Mittel sind definiert als:
"Stoffe oder Gemische, die dazu bestimmt sind, äußerlich mit den verschiedenen Teilen des menschlichen Körpers (Haut, Behaarungssystem, Nägel, Lippen und äußere intime Regionen) oder mit den Zähnen und den Schleimhäuten der Mundhöhle in Berührung zu kommen, und zwar zu dem ausschließlichen oder überwiegenden Zweck: diese zu reinigen, zu parfümieren, ihr Aussehen zu verändern, sie zu schützen, sie in gutem Zustand zu halten, oder den Körpergeruch zu beeinflussen."
Hier finden Sie Links zu relevanten Gesetzestexten sowie zu Leitlinien und Empfehlungen von kosmetischen Mitteln. Was ist zu beachten, wenn man kosmetische Mittel verkaufen möchte? Welche Aufgaben hat die verantwortliche Person und der Handel? Wichtige Informationen zur Produktinformationsdatei/Sicherheitsbewertung (Wie soll eine PID aussehen und wer darf eine erstellen?) und die Kontaktdaten.
Kosmetikrecht
Kosmetische Mittel sind in folgenden Gesetzen geregelt:
- Die Verordnung Verordnung (EG) Nr. 1223/2009 über kosmetische Mittel gilt für alle kosmetischen Mitteln, die in der EU bereitgestellt werden und besteht aus 40 Artikeln und 71 Erwägungsgründen, die 10 Anhänge gliedern sich folgendermaßen:
| Anhang I: | Sicherheitsbericht (Sicherheitsinformationen + Bewertung) |
| Anhang II: | verbotene Stoffe |
| Anhang III: | eingeschränkt zugelassene Stoffe |
| Anhang IV: | Farbstoffe |
| Anhang V: | Konservierungsstoffe |
| Anhang VI: | UV-Filter |
| Anhang VII: | Symbole |
| Anhang VIII: | Alternativmethoden zu Tierversuchen |
| Anhang IX: | Teil A - Aufgehobene Richtlinie, Teil B - Verzeichnis für die Fristen der Umsetzung |
| Anhang X: | Entsprechungstabelle |
- In der Kosmetik-Claims-Verordnung (EU) Nr. 655/2013 werden gemeinsame Kriterien zur Begründung von Werbeaussagen im Zusammenhang mit kosmetischen Mitteln festgelegt. Leitlinie zu der Verordnung (EU) Nr. 655/2013
- Im Lebensmittel- und Verbraucherschutzgesetz (LMSVG) BGBl. I Nr. 13/2006 idgF werden die Anforderungen an kosmetische Mittel und die damit verbundene Verantwortung der Unternehmer geregelt.
- In der Kosmetik-Durchführungsverordnung BGBl. II Nr. 330/2013 wird die nationale Regelung zur Kennzeichnung verpackter und unverpackter kosmetischer Mittel geregelt.
Weitere Leit- und Richtlinien sind:
Im Österreichischen Lebensmittelbuch (kurz: Codex) wird u.a. zusammengefasst, was die allgemeine Verkehrsauffassung in Österreich betrifft. Es handelt sich um ein objektiviertes Sachverständigengutachten. Es dient der Verlautbarung von Sachbezeichnungen, Begriffsbestimmungen, Untersuchungsmethoden und Beurteilungsgrundsätzen sowie von Richtlinien „für das Herstellen und Inverkehrbringen von Waren“. Für Kosmetikhersteller relevante Kapitel sind:
- Kosmetische Mittel B33: Naturkosmetik, Franzbranntwein, Sonnenschutzmittel
- Gute Herstellungspraxis
Biokosmetik-Regelung: Richtlinie - Landwirtschaftliche Produkte aus biologischer Produktion und daraus hergestellte Folgeprodukte (RL Biologische Produktion)
Internationale Richtlinien und Bewertungen
Inverkehrbringen von Kosmetik
Die Europäische Kosmetik Verordnung (EG) Nr. 1223/2009 schreibt vor:
"Die auf dem Markt bereitgestellten kosmetischen Mittel müssen bei normaler oder vernünftigerweise vorhersehbarer Verwendung für die menschliche Gesundheit sicher sein, insbesondere unter Berücksichtigung folgender Punkte: Aufmachung, Kennzeichnung, Gebrauchs- und Entsorgungsanweisungen, sonstige Angaben oder Informationen seitens der verantwortlichen Person. Die Anbringung von Warnhinweisen entbindet die verantwortliche Person nicht von der Verpflichtung, die übrigen Anforderungen der Verordnung zu erfüllen."
Für das Inverkehrbringen (erstmalige Bereitstellung auf dem Gemeinschaftsmarkt) von kosmetischen Mitteln gibt es keine Zulassungspflicht, d.h. keine behördliche Überprüfung vor der Markteinführung.
Vor dem Inverkehrbringen müssen allerdings alle Anforderungen und Auflagen des Kosmetikrechts (Sicherheitsbericht, verbotene Stoffe etc.) erfüllt sein. Der Unternehmer muss seine Produkte auf der europäischen Datenbank CPNP notifizieren. Importeure, die Produkte aus Drittländern beziehen, sind juristisch gesehen Herstellern gleichgestellt. Die importierten Produkte müssen deshalb dem EU-Recht entsprechend hergestellt und gekennzeichnet sein (Details siehe Aufgaben der verantwortlichen Person und des Händlers).
Verantwortliche Person und ihre Aufgaben
Die verantwortliche Person ist (eine juristische oder eine natürliche Person):
- die Herstellerin/der Hersteller (natürliche/juristische Person, die ein kosmetisches Mittel herstellt oder natürliche/juristische Person, die ein kosmetisches Mittel herstellen bzw. entwickeln lässt und es unter ihrem eigenen Namen oder ihrer eigenen Marke in Verkehr bringt) oder
- die Importeurin/der Importeur oder
- unter gewissen Umständen die Händlerin/der Händler oder
- eine innerhalb der EU ansässige Person, an welche die Herstellerin/der Hersteller, Importeurin/Importeur bzw. Händlerin/Händler die Verantwortung mit schriftlichem Mandat weitergibt.
Gemäß der Art. 4 und 5 hat die verantwortliche Person die Einhaltung der Verordnung für jedes in ihrer Verantwortung liegende in Verkehr gebrachte kosmetische Mittel zu gewährleisten.
Verpflichtungen der verantwortlichen Person
- Sicherheit (Art. 3) - Kosmetische Mittel müssen bei normaler oder vernünftigerweise vorhersehbarer Verwendung für die menschliche Gesundheit sicher sein
- Notifizierung (Art. 13) - Vor dem Inverkehrbringen ist das kosmetische Mittel der Kommission auf elektronischem Wege zu notifizieren
- Herstellung gemäß der Guten Herstellungspraxis (Art. 8)
- Erstellen und führen der Produktinformationsdatei und der Sicherheitsbewertung (Art. 10 + 11)
- CMR-Stoffe (Art. 15) und verbotene Stoffe (Art. 14 iVm Anhang II) dürfen nicht eingesetzt werden, die in den Anhängen III-VI genannten Stoffe nur gemäß den festgelegten Einschränkungen
- Nanomaterialien (Art.16) - Zusätzlich zur Notifizierung gemäß Art. 13 sind kosmetische Mittel, die Nanomaterialien enthalten, der Kommission auf elektronischem Wege sechs Monate vor dem Inverkehrbringen zu melden
- Kennzeichnung (Art. 19) und Werbeaussagen (Art. 20)
- Meldung ernster unerwünschter Wirkungen (Art. 23)
- Information der Öffentlichkeit über die qualitative und quantitative Zusammensetzung und über (schwere) unerwünschte Wirkungen (Art. 21)
In den folgenden Abschnitten werden die Aufgaben der verantwortlichen Person genauer beschrieben.
Aufgaben der Händlerinnen und Händler
Gemäß Artikel 2 Abs. 1 lit. e ist eine „Händlerin“/ein „Händler“ jede natürliche oder juristische Person in der Lieferkette, die ein kosmetisches Mittel auf dem Gemeinschaftsmarkt bereitstellt, mit Ausnahme der Herstellerin/des Herstellers oder des Importeurs.
Die Händlerin oder der Händler ist dann die verantwortliche Person (gemäß Artikel 4 Abs. 6), wenn sie/er: ein kosmetisches Mittel unter seinem eigenen Namen und seiner eigenen Marke in Verkehr bringt oder ein Produkt, das sich bereits in Verkehr befindet, so ändert, dass die Einhaltung der geltenden Anforderungen berührt sein kann.
Die Übersetzung der Kennzeichnung und Information am kosmetischen Mittel, das bereits in Verkehr gebracht wurde, gilt in dieser Hinsicht nicht als Änderung. Jedoch ergibt sich aus der Übersetzung die Notwendigkeit der Notifizierung durch die Händlerin und den Händler. Bevor die Händlerin oder der Händler ein Produkt auf dem Markt bereitstellt, überprüft sie oder er die Kennzeichnung insbesondere hinsichtlich:
- Name und Anschrift, Ursprungsland, Chargennummer, Bestandteilliste
- ob die Kennzeichnung in deutscher Sprache angebracht ist
- ob das Mindesthaltbarkeitsdatum nicht abgelaufen ist
Die Händlerin oder der Händler gewährleistet, dass die Lagerungs- oder Transportbedingungen den Anforderungen der Verordnung genügen. Hat eine Händlerin oder ein Händler Grund zur Annahme, dass ein kosmetisches Mittel nicht den Vorgaben dieser Verordnung entspricht,
- stellt er/sie das Produkt nicht auf dem Markt bereit
- leitet er/sie entsprechende Korrekturmaßnahmen ein
- unterrichtet unverzüglich die verantwortliche Person und die zuständigen Behörden, wenn ein Risiko von dem Produkt ausgeht.
Bewertung der Sicherheit von Kosmetik
Alle am Markt befindlichen kosmetischen Mittel müssen vor der Markteinführung (besser bereits während der Entwicklungsphase) einer Sicherheitsbewertung durch qualifizierte Expertinnen und Experten unterzogen werden. Hierbei wird unter anderem eine toxikologische Beurteilung der Inhaltsstoffe unter Berücksichtigung der Expositionsbedingungen (Einsatzkonzentration, Applikationsdauer, Anwendungsort) durchgeführt.
Produktinformationsdatei
Die Produktinformationsdatei enthält folgende Daten in einer leicht verständlichen Sprache für die zuständige Behörde des jeweiligen Mitgliedsstaats (im Regelfall auf Deutsch):
- die Beschreibung des kosmetischen Mittels
- den Sicherheitsbericht
- die Herstellungsmethode unter dem Aspekt der guten Herstellungspraxis
- Nachweis der angepriesenen Wirkung
- Daten über durchgeführte Tierversuche
Die verantwortliche Person macht die Produktinformationsdatei an ihrer Anschrift, die auf dem Etikett angegeben wird, in elektronischem oder anderem Format für die zuständige Behörde leicht zugänglich. Die Produktinformationsdatei ist für jedes einzelne kosmetische Mittel, das am Markt bereitgestellt wird, zu erstellen und aktuell zu halten. Sie wird während eines Zeitraums von zehn Jahren nach dem Zeitpunkt aufbewahrt, zu dem die letzte Charge des kosmetischen Mittels in Verkehr gebracht wurde.
Sicherheitsbericht
Der Sicherheitsbericht (Art 10 + Anhang I) ist das Kernstück der Produktinformationsdatei. Er ist bereits vor dem Inverkehrbringen des kosmetischen Mittels von der Sicherheitsbewerterin und vom Sicherheitsbewerter in Zusammenarbeit mit der verantwortlichen Person zu erstellen. Der Sicherheitsbericht besteht aus zwei Teilen:
1) Die Sicherheitsinformation erfasst alle wesentlichen Merkmale des kosmetischen Produkts und seiner Inhaltsstoffe, die für die Sicherheit des Produkts relevant sein können:
- Zusammensetzung des Produkts
- physikalisch/chemische Eigenschaften und Stabilität
- Mikrobiologische Qualität
- Verunreinigungen, Spuren und Verpackungsmaterial
- normaler und vernünftigerweise vorhersehbarer Gebrauch
- Exposition gegenüber dem Produkt und den verwendeten Stoffen
- Toxikologisches Profil der Stoffe
- (ernste) unerwünschte Wirkungen
2) In der Sicherheitsbewertung wird auf Grund der Daten des Sicherheitsberichts die Sicherheit des kosmetischen Mittels – ggf. unter Anbringung gewisser Warnhinweise - begründet.
Sicherheitsbewerterin und Sicherheitsbewerter
Sicherheitsbewertungen dürfen nur von Personen erstellt werden, die folgende Anforderungen (gemäß Kosmetik Verordnung (EG) 1223/2009 Artikel 10, Absatz 2) erfüllen:
„Die Sicherheitsbewertung des kosmetischen Mittels wird, wie in Anhang I Teil B ausgeführt, durch eine Person durchgeführt, die im Besitz eines Diploms oder eines anderen Nachweises formaler Qualifikation ist, der nach Abschluss eines theoretischen und praktischen Hochschulstudiengangs in Pharmazie, Toxikologie, Medizin, oder einem ähnlichen Fach oder eines von einem Mitgliedsstaat als gleichwertig anerkannten Studiengangs erteilt worden ist.“
Eine Auflistung der in Österreich tätigen und vom Gesundheitsministerium autorisierten Lebensmittel- und Kosmetik-Gutachter:innen gemäß § 73 LMSVG finden Sie in der Liste des BMASGPK (Kosmetik-Gutachter:innen sind zugelassen für die Gruppe C Z 9 "Kosmetische Mittel" und Kosmetik-Sicherheitsheitsbewerter:innen benötigen zusätzlich die Gruppe F Z 13 "Toxikologische Bewertung von Waren, die dem Lebensmittelsicherheits- und Verbraucherschutzgesetz - LMSVG unterliegen" (eingeschränkt auf Waren der Gruppe C Z 9 – kosmetische Mittel) ). Voraussetzungen und Anforderungen an Sicherheitsbewerter:innen und Gutachter:innen werden auf der Seite des BMASGPK erläutert.
Leitlinien und Vorlagen
Als Hilfestellung können folgende Leitlinien zur Erstellung der Produktinformationsdatei bzw. des Sicherheitsberichts herangezogen werden:
Mikrobiologische Anforderungen
Die Sicherstellung der mikrobiologischen Qualität obliegt der verantwortlichen Person, beraten durch ihre Sicherheitsbewerterin und ihren Sicherheitsbewerter. Stand der Technik für die mikrobiologische Qualität für kosmetische Fertigprodukte ist sowohl in der ÖNORM EN ISO 17516: 2015 01 01 Kosmetische Mittel - Mikrobiologie - Mikrobiologische Grenzwerte (ISO 17516:2014) als auch in der 11. Revision der SCCS Notes of Guidance (SCCS/1628/21, Appendix 9) festgelegt.
Quantitative Spezifikation
Kategorie 1: kosmetische Mittel, die für eine Anwendung im Augenbereich, auf Schleimhäuten und bei Kindern unter drei Jahren vorgesehen sind - Gesamtlebendkeimzahl für aerobe mesophile Mikroorganismen: nicht mehr als 10² koloniebildende Einheiten pro Gramm bzw. Milliliter (KBE/g bzw. ml).
Kategorie 2: Sonstige Produkte - Gesamtlebendkeimzahl für aerobe mesophile Mikroorganismen: nicht mehr als 10³ KBE/g bzw. ml.
Qualitative Spezifikation
Die gesundheitliche Sicherheit kosmetischer Mittel kann durch eine Vielzahl pathogener Erreger gefährdet werden. Zur orientierenden Beurteilung dienen die im Folgenden beschriebenen Indikatorkeime. Fallweise ist bei hinreichendem Verdacht auch auf weitere Pathogene zu prüfen. Die folgenden spezifischen Mikroorganismen dürfen nicht nachweisbar sein: Pseudomonas aeruginosa, Staphylococcus aureus, Candida albicans, Escherichia coli.
Konservierung
Die Kosmetikverordnung (EG) 1223/2009 sieht vor, dass im Sicherheitsbericht Teil A (laut Annex I, Z3) auch Ergebnisse aus Konservierungsbelastungstests zur Beurteilung der mikrobiologischen Qualität herangezogen werden. Siehe auch "Challenge testing" in den SCCS Notes of Guidance, 11. Revision, Appendix 9. Weiterführende Informationen zur Konservierung finden Sie unter "Haltbarkeit von Kosmetik"
Empfehlungen, Publikationen und Leitfäden
Zum Thema Mikrobiologie und Hygiene von Kosmetika haben Expertinnen und Experten der Fachgruppe Mikrobiologie und Betriebshygiene der deutschen Gesellschaft für wissenschaftliche und angewandte Kosmetik (DGK e.V.) einige Publikationen und Bücher zur Verfügung gestellt, diese finden Sie hier.
Der Industrieverband für Körperpflege- und Waschmittel e. V. (IKW) hat einen sehr ausführlichen Leitfaden für Mikrobiologisches Qualitätsmanagement (MQM) kosmetischer Mittel (IKW 1998) herausgegeben.
Folgende Ö-NORMEN können Sie hier beziehen:
- Kosmetische Mittel - Mikrobiologie - Leitlinien für die Risikobewertung und Identifikation von mikrobiologisch risikoarmen Produkten (ISO 29621:2010)
ÖNORM EN ISO 29621: 2011 03 01 - Kosmetische Mittel - Mikrobiologie - Mikrobiologische Grenzwerte (ISO 17516:2014)
ÖNORM EN ISO 17516: 2015 01 01 - Kosmetik - Mikrobiologie - Allgemeine Anleitungen zur mikrobiologischen Untersuchung (ISO 21148:2005)
ÖNORM EN ISO 21148: 2009 10 01 - Kosmetik - Mikrobiologie - Zählung und Nachweis von aeroben mesophilen Bakterien (ISO 21149:2006)
ÖNORM EN ISO 21149: 2009 10 01 - Kosmetische Mittel - Mikrobiologie - Nachweis von Staphylococcus aureus (ISO/FDIS 22718:2015)
ÖNORM EN ISO 22718: 2015 08 01 - Kosmetische Mittel - Mikrobiologie - Nachweis von Pseudomonas aeruginosa (ISO/FDIS 22717:2015)
ÖNORM EN ISO 22717: 2015 08 01 - Kosmetische Mittel - Mikrobiologie - Nachweis von Candida albicans (ISO/FDIS 18416:2015)
ÖNORM EN ISO 18416: 2015 08 01 - Kosmetische Mittel - Mikrobiologie - Nachweis von Escherichia coli (ISO/FDIS 21150:2015)
ÖNORM EN ISO 21150: 2015 08 01 - Kosmetik - Mikrobiologie - Nachweis von spezifizierten und nichtspezifizierten Mikroorganismen (ISO 18415:2007, korrigierte Fassung 2007-12)
ÖNORM EN ISO 18415: 2011 07 15 - Kosmetik - Mikrobiologie - Zählung von Hefen und Schimmelpilzen (ISO 16212:2008)
ÖNORM EN ISO 16212: 2011 07 15 - Kosmetische Mittel - Mikrobiologie - Bewertung des antimikrobiellen Schutzes eines kosmetischen Produktes (ISO 11930:2012, korrigierte Fassung 2013-05-01)
ÖNORM EN ISO 11930: 2014 03 01
Notifizieren
Jedes kosmetische Produkt ist vor dem Inverkehrbringen von der verantwortlichen Person der Europäischen Kommission auf elektronischem Wege zu melden (Art. 13).
Zur Durchführung der Notifizierung wurde das "Cosmetic Products Notification Portal (CPNP)" installiert.
Das Benutzerhandbuch CPNP (Cosmetic Products Notification Portal bzw. Meldeportal für kosmetische Mittel) für verantwortliche Personen und Händlerin/Händler (Deutsche Fassung, letzte Aktualisierung: 07.03.2018) hilft bei der Anmeldung und Eintragung von Ihren kosmetischen Mitteln. Weitere deutschsprachige Anleitungen zu Registrierung und Nutzung des Notifizierungsportals werden auf der Homepage des Bundesministeriums für Arbeit, Soziales, Gesundheit, Pflege und Konsumentenschutz (BMASGPK) zum Download angeboten.
Übersetzt eine Händlerin oder ein Händler auf eigene Initiative ein Element der Kennzeichnung eines kosmetischen Mittels, das bereits in einem anderen Mitgliedstaat in Verkehr gebracht wurde, so hat sie/er ebenfalls bestimmte Daten der Europäischen Kommission auf elektronischem Wege zu melden (siehe Art. 13 Abs. 3 der Verordnung (EG) Nr. 1223/2009).
Gute Herstellerpraxis von Kosmetik
Unter Kosmetik-GMP (Good Manufacturing Practice) bzw. "Guter Herstellungspraxis" versteht man Verhaltensmaßnahmen und Vorschriften, die bei der Herstellung von kosmetischen Produkten beachtet und eingehalten werden müssen, mit dem Ziel, diese Produkte reproduzierbar in der gewünschten Qualität herzustellen.
Die gesetzliche Verpflichtung zur Anwendung der Prinzipien der „Guten Herstellungspraxis“ ergibt sich aus Artikel 8 der Kosmetik-Verordnung (EG) Nr. 1223/2009.
Wie eine Gute Herstellungspraxis umgesetzt werden kann, finden Sie in folgenden Dokumenten und Richtlinien:
- Cosmetics - Good Manufacturing Practices (GMP) - Guidelines on Good Manufacturing Practices (EN ISO 22716:2007) bzw. Kosmetik - GMP - Leitfaden zur guten Herstellungspraxis (ÖNORM EN ISO 22716)
- Leitlinie der österr. Codexkommission zur Herstellung kosmetischer Mittel gemäß den Grundsätzen der „Guten Herstellungspraxis“ (Kosmetik-GMP). Bei der Erstellung dieser Leitlinie wurden einige Begriffsdefinitionen und einige inhaltliche Punkt von „Cosmetics-GMP-Guideline on Good Manufacturing Practices“ ISO/TC 217 N78 herangezogen, welcher auf internationaler Ebene anerkannt wird.
Folgendes Buch zur Mikrobiologie und Betriebshygiene kann als Unterstützung herangezogen werden:
- DGK-Handbuch "Betriebshygiene in der Kosmetik" - 2. überarbeitete Ausgabe 2019. Verlag für Chemische Industrie, H. Ziolkowsky GmbH, D-86470 Thannhausen/Burg, ISBN 978-3-87846-07-8
Die Anforderungen an ein mikrobiologisch und hygienisch einwandfreies Produkt werden stets höher. Dieses Buch wurde aus der mikrobiologischen bzw. hygienischen Sicht geschrieben und soll den Praktikerinnen und Praktikern in den Betrieben wie Betriebsleiterinnen und Betriebsleitern, Entwicklerinnen und Entwicklern sowie den Verantwortlichen für Qualitätssicherung und -prüfung, aber auch Fachleuten anderer Richtungen Verfahrensanleitungen und praktische Hinweise zur Umsetzung der Betriebshygiene geben. Es werden hier alle betriebshygienisch wichtigen Gesichtspunkte zusammengetragen, so dass ein guter Überblick über den heutigen Wissensstand des Fachgebietes ermöglicht wird.
Kennzeichnung von Kosmetik
Verpflichtende Angaben
Folgende Angaben müssen deutlich sichtbar, leicht lesbar und unverwischbar auf der Verpackung UND dem Behältnis des kosmetischen Mittels laut Artikel 19, Absatz 1 der Verordnung (EU) 1223/2009 angebracht werden (unter Berücksichtigung einiger Ausnahmen):
Den Namen oder die Firma und die Anschrift der verantwortlichen Person. Die Angaben dürfen abgekürzt werden, sofern diese Person und ihre Adresse aus der Abkürzung identifiziert werden kann. Zum gegenwärtigen Zeitpunkt reicht eine Internetadresse alleine nicht aus. Es ist die postalische Anschrift mit Straße, PLZ und Ortsnamen anzugeben. Werden mehrere Anschriften angegeben, so ist die Anschrift der verantwortlichen Person, bei der die Produktinformationsdatei leicht zugänglich gemacht wird, hervorzuheben (z. B. unterstreichen). Das Ursprungsland ist anzugeben, wenn das Produkt aus einem Drittstaat auf dem Gemeinschaftsmarkt in Verkehr gebracht wird. In welcher Form diese Angabe zu erfolgen hat, ist nicht geregelt, z.B. „Hergestellt in China“.
Den Nenninhalt zur Zeit der Abfüllung, als Gewichts- oder Volumenangabe; hiervon ausgenommen sind Packungen, die weniger als 5 g oder weniger als 5 ml enthalten, Gratisproben und Einmalpackungen; bei Vorverpackungen, die in der Regel als Großpackungen mit mehreren Stücken verkauft werden und für die die Gewichts- und Volumenangabe nicht von Bedeutung ist, ist die Angabe des Inhalts nicht erforderlich, sofern die Stückzahl auf der Verpackung angegeben ist. Die Angabe der Stückzahl ist nicht erforderlich, wenn sie von außen leicht zu erkennen ist oder wenn das Erzeugnis in der Regel nur als Einheit verkauft wird.
Das Datum, bis zu dem das kosmetische Mittel bei sachgemäßer Aufbewahrung seine ursprüngliche Funktion erfüllt und insbesondere mit Artikel 3 vereinbar ist („Mindesthaltbarkeitsdatum“). Vor dem Datum selbst oder dem Hinweis auf die Stelle, an der es auf der Verpackung angegeben ist, steht das in Anhang VII Nummer 3 der Verordnung (EG) 1223/2009 angegebene Symbol der Sanduhr oder die Wörter: „Mindestens haltbar bis“.
Das Mindesthaltbarkeitsdatum wird eindeutig angegeben und setzt sich entweder aus dem Monat und dem Jahr oder dem Tag, dem Monat und dem Jahr in dieser Reihenfolge zusammen. Diese Angaben werden erforderlichenfalls durch die Angabe der Aufbewahrungsbedingungen ergänzt, die zur Gewährleistung der angegebenen Haltbarkeit erfüllt sein müssen. Für kosmetische Mittel mit einer Mindesthaltbarkeit von mehr als 30 Monaten ist die Angabe des Mindesthaltbarkeitsdatums nicht vorgeschrieben. Für solche Erzeugnisse wird angegeben, wie lange das Mittel nach dem Öffnen sicher ist und ohne Schaden für die Verbraucherin und den Verbraucher verwendet werden kann. Für solche Erzeugnisse wird, außer wenn das Konzept der Haltbarkeit nach dem Öffnen nicht relevant ist, angegeben, wie lange das Mittel nach dem Öffnen sicher ist. Diese Information wird durch das in Anhang VII Nummer 2 dargestellte Symbol des geöffneten Cremetiegels, gefolgt von dem Zeitraum (ausgedrückt in Monaten und/oder Jahren) angegeben.
Die besonderen Vorsichtsmaßnahmen für den Gebrauch, mindestens die in den Anhängen III bis VI der Verordnung (EG) 1223/2009 aufgeführten Angaben und etwaige besondere Vorsichtshinweise bei kosmetischen Mitteln, die zum gewerblichen Gebrauch bestimmt sind.
Die Chargennummer oder das Zeichen, das eine Identifizierung des kosmetischen Mittels ermöglicht. Ist dies aus praktischen Gründen wegen der geringen Abmessungen der kosmetischen Mittel nicht möglich, so brauchen diese Angaben nur auf der Verpackung zu stehen.
Der Verwendungszweck des kosmetischen Mittels, sofern dieser sich nicht aus der Aufmachung dessen ergibt.
Die Angabe der Bestandteile erfolgt unter Verwendung der gemeinsamen Bezeichnung der Bestandteile gemäß dem Glossar, das im Amtsblatt der EU veröffentlicht wurde: Durchführungsbeschluss (EU) 2022/677 der Kommission vom 31. März 2022. Ist keine gemeinsame Bestandteilsbezeichnung vorhanden, so ist eine Bezeichnung aus einer allgemein anerkannten Nomenklatur zu verwenden.
Unterstützend und übersichtlicher ist die Datenbank der Kommission für kosmetische Bestandteile: CosIng
Die Inhaltsstoffe sind mit der Internationalen Nomenklatur für kosmetische Inhaltsstoffe (INCI) angeführt. CosIng stellt jedoch keine Positivliste kosmetischer Bestandteile dar, sondern ist lediglich eine Sammlung von Bestandteilen, die seitens der Industrie genannt wurden.
Zusätzlich müssen 26 Parfüminhaltsstoffe (allergene Duftstoffe) aufgrund ihres allergieauslösenden Potenzials ab einer bestimmten Konzentration deklariert werden. Mehr zum Thema, siehe Allergene Duftstoffe
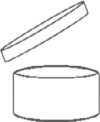
Das Symbol des geöffneten Cremetiegels gibt den Zeitraum an, in welchem das kosmetische Mittel nach Öffnung des Produktes noch als sicher anzusehen ist (Haltbarkeitsdauer nach dem Öffnen bzw. Period after opening - PAO). Die Angabe dieses Zeitraums in Monaten bzw. Jahren erfolgt in oder neben dem Tiegelsymbol. Dabei werden Monate mit "M" und Jahre mit "J" abgekürzt. Sie ist sowohl auf dem Behältnis als auch auf der äußeren Verpackung zu deklarieren.

Vor dem Datum selbst oder dem Hinweis auf die Stelle, an der das Mindesthaltbarkeitsdatum auf der Verpackung angegeben ist, steht das Sanduhr-Symbol oder der Wortlaut "Mindestens haltbar bis..."

Sonnenschutzmittel mit diesem Symbol (Kreis mit Inschrift UVA) deklarieren, dass das vorliegende kosmetische Mittel den Empfehlungen der EU zur Mindestwirksamkeit des Lichtschutzes gegenüber UV-B und UV-A Strahlung entspricht. Siehe "Empfehlung 2006/647/EG der Kommission über die Wirksamkeit von Sonnenschutzmitteln und diesbezügliche Herstellerangaben.
Allergene Duftstoffe
Laut Kosmetikverordnung (EG) Nr. 1223/2009 (Artikel 19) müssen 26 Inhaltsstoffe (Anhang III) aufgrund ihres allergieauslösenden Potenzials zusätzlich deklariert werden.
Es reicht nicht aus, diese unter dem Sammelbegriff „Parfum“ oder pflanzlichen Zubereitungen wie ätherische Öle und Extrakte anzugeben, wenn die einzelnen Stoffe in einer Konzentration von mehr als 0,001 % bei Mitteln, die auf der Haut/in den Haaren verbleiben („Leave-on“-Produkte) oder 0,01 % bei Mitteln, die abgespült bzw. ausgespült („Rinse-off“-Produkte) werden enthalten sind.
| Lfd. Nr. | INCI-Bezeichnung | andere Bezeichnungen | CAS-Nr. |
|---|---|---|---|
| 45 | Benzyl Alcohol | 100-51-6 | |
| 67 | Amyl Cinnamal | 122-40-7 | |
| 69 | Cinnamyl Alcohol | 104-54-1 | |
| 70 | Citral | 5392-40-5 | |
| 71 | Eugenol | 97-53-0 | |
| 72 | Hydroxycitronellal | 107-75-5 | |
| 73 | Isoeugenol | 97-54-1 | |
| 74 | Amylcinnamyl Alcohol | 101-85-9 | |
| 75 | Benzyl Salicylate | 118-58-1 | |
| 76 | Cinnamal | 104-55-2 | |
| 77 | Coumarin | 91-64-5 | |
| 78 | Geraniol | 106-24-1 | |
| 80 | Anise Alcohol | Anisylalkohol | 105-13-5 |
| 81 | Benzyl Cinnamate | 103-41-3 | |
| 82 | Farnesol | 4602-84-0 | |
| 84 | Linalool | 78-70-6 | |
| 85 | Benzyl Benzoate | 120-51-4 | |
| 86 | Citronellol | 106-22-9 | |
| 87 | Hexyl Cinnamal | Hexylcinnamaldehyd | 101-86-0 |
| 88 | Limonene | d-Limonen | 5989-27-5 |
| 89 | Methyl 2-Octynoate | Methylheptincarbonat | 111-12-6 |
| 90 | Alpha-Isomethyl Ionone | 127-51-5 | |
| 91 | Evernia Prunastri Extract | Eichenmoosextrakt | 90028-68-5 |
| 92 | Evernia Furfuracea Extract | Baummoosextrakt | 90028-67-4 |
Die beiden folgenden allergenen Duftstoffe wurden in die Verbotsliste, Anhang II, aufgenommen und dürfen nicht mehr in kosmetischen Mitteln eingesetzt werden:
*) Der Duftstoff "Hydroxyisohexyl 3-cyclohexene carboxaldehyde" (Anhang II/ Nr. 1380) wurde aufgrund seiner sensibilisierenden Eigenschaften verboten. Seit dem 23. August 2021 ist dieser Stoff verboten (Verordnung (EU) Nr. 2017/1410).
**) Butylphenyl Methylpropional (Anhang II/ Nr. 1666) wurde wegen seiner Einstufung als CMR (reprotoxisch) mit 1. März 2022 verboten (Verordnung (EU) Nr. 2021/1902)
Die neuen Regelungen zur Duftstoffkennzeichnung finden Sie hier.
Für die Umstellung der Informationen auf den kosmetischen Produkten wird den Herstellern ein Übergangszeitraum von drei bzw. fünf Jahren eingeräumt:
- Für alle Neuprodukte (Inverkehrbringen): 3 Jahre (31. Juli 2026)
- Für alle Produkte, die bereits im Markt sind (Bereitstellen am Markt): 5 Jahre (31. Juli 2028)
Werbeaussagen von Kosmetik
Werbeaussagen müssen nützlich, verständlich und zuverlässig sein und es den Endverbraucherinnen und Endverbrauchern ermöglichen, eine fundierte Kaufentscheidung zu treffen.
Die Anforderungen an die Werbung sind in der Verordnung (EG) Nr. 1223/2009 Artikel 20 "Werbeaussagen" und der Verordnung (EU) Nr. 655/2013 zur Festlegung gemeinsamer Kriterien zur Begründung von Werbeaussagen im Zusammenhang mit kosmetischen Mitteln geregelt.
Bei der Kennzeichnung, der Bereitstellung auf dem Markt und der Werbung für kosmetische Mittel dürfen nach diesen beiden Verordnungen keine Texte, Bezeichnungen, Warenzeichen/Marken, Abbildungen und andere bildhafte oder nicht bildhafte Zeichen verwendet werden, die Merkmale oder Funktionen vortäuschen, die die betreffenden Erzeugnisse nicht besitzen.
Kriterienkatalog zu Werbeaussagen
Die Verordnung (EU) Nr. 655/2013 umfasst folgende Kriterien zu Werbeaussagen laut Anhang:
- Darstellungen zur Wirkung eines Produkts dürfen nicht über das hinausgehen, was die vorhandenen Nachweise belegen.
- Werbeaussagen dürfen dem Produkt keine besonderen bzw. einzigartigen Eigenschaften zusprechen, wenn ähnliche Produkte dieselben Eigenschaften aufweisen (Werbung mit Selbstverständlichkeit).
- Ist die Wirkung eines Produkts an bestimmte Bedingungen gekoppelt, so muss dies klar angegeben werden, zB die Verwendung gemeinsam mit anderen Produkten.
- Keine Werbung, dass Produkt von einer Behörde zugelassen oder genehmigt wurde
- Zulässigkeit der Werbeaussage richtet sich danach, wie der durchschnittliche Endverbraucher (angemessen gut unterrichtet, aufmerksam und kritisch) diese Aussage unter Berücksichtigung der sozialen, kulturellen und sprachlichen Faktoren wahrnimmt
- Keine Werbung, die einem Produkt einen bestimmten Nutzen zuschreibt, der jedoch nur in der Erfüllung der rechtlichen Mindestanforderungen besteht
- Werbeaussagen müssen klar und verständlich sein.
- Werbeaussagen müssen Informationen enthalten, um eine fundierte Kaufentscheidung zu treffen.
- Zielgruppe muss in der Lage sein, die Aussage zu erfassen, dh Marketing-Aussagen müssen klar, präzise, relevant und für die Zielgruppe verständlich sein.
- Keine Werbung, dass Produkt von einer Behörde zugelassen oder genehmigt wurde
- Zulässigkeit der Werbeaussage richtet sich danach, wie der durchschnittliche Endverbraucher (angemessen gut unterrichtet, aufmerksam und kritisch) diese Aussage unter Berücksichtigung der sozialen, kulturellen und sprachlichen Faktoren wahrnimmt
- Keine Werbung, die einem Produkt einen bestimmten Nutzen zuschreibt, der jedoch nur in der Erfüllung der rechtlichen Mindestanforderungen besteht
- Wird mit einem Bestandteil geworben, muss dieser gezielt vorhanden sein
- Wird einem Bestandteil eine Eigenschaft zugeschrieben, muss auch das Endprodukt dieselben Eigenschaften aufweisen
- Meinungsäußerungen dürfen nicht vortäuschen, nachgeprüfte Aussagen zu sein
- Werbeaussagen müssen durch hinreichende und überprüfbare Nachweise belegt werden
- Nachweise müssen dem Stand der Technik berücksichtigen
- Studien müssen relevant für das Produkt und den behaupteten Nutzen sein, auf einwandfrei entwickelten und angewandten Methoden (gültig, zuverlässig und reproduzierbar) basieren und ethischen Erwägungen Rechnung tragen.
- Beweiskraft muss mit der Art der getätigten Aussagen in Einklang stehen, insbesondere für Aussagen, bei denen eine fehlende Wirksamkeit ein Sicherheitsproblem verursachen könnte.
- Eindeutig übertriebene Behauptungen müssen nicht belegt werden.
- Eigenschaften eines Bestandteils, die sich auf das Endprodukt beziehen, müssen durch hinreichende und überprüfbare Nachweise belegt werden: durch wirksame Konzentration des Bestandteils im Produkt.
- Annehmbarkeit einer Werbeaussage stützt sich auf das Gewicht der Nachweise sämtlicher verfügbarer Studien, Daten und Informationen und richtet sich nach der Art der Werbeaussage und dem allgemeinen Wissensstand der Endverbraucher.
Die dazugehörige Leitlinie („Technical document on cosmetic claims“) zu der Verordnung (EU) Nr. 655/2013 beinhaltet:
- ANHANG I: Gemeinsame Kriterien für Werbeaussagen im Zusammenhang mit kosmetischen Mitteln mit Beispielen und Anmerkungen
- ANHANG II: ‚Best practice‘ für Nachweise zur Bestätigung von Werbeaussagen
- ANHANG III: Frei von-Claims
- ANHANG IV: Hypoallergen-Claim
Krankheitsbezogene Aussagen
Wirbt ein kosmetisches Mittel mit Aussagen, dass das Mittel zur Heilung oder zur Linderung oder zur Verhütung menschlicher Krankheiten oder krankhafter Beschwerden bestimmt ist, kann es unter die Definition eines Arzneimittels fallen und ist folglich unzulässig (siehe Abgrenzung von kosmetischen Mitteln).
Abgrenzung & Borderline-Manual
Die Einstufung als kosmetisches Mittel ist in manchen Fällen nicht ohne Weiteres zu treffen. Sie muss daher im Einzelfall von Fachexperten aufgrund von Funktion, Zusammensetzung, Wirkung, Produktaufmachung, Anwendungsort oder Anwendungszweck entschieden werden.
Überschneidungen von Kosmetika zu anderen Warengruppen wie Arzneimitteln, Bioziden, Gebrauchsgegenständen, Spielzeug, Lebensmittel oder Medizinprodukten sind möglich. Kosmetika müssen der gesetzlichen Definition kosmetischer Mittel entsprechen. Es gibt auch Stoffe bzw. Gemische, die nicht als Kosmetik gelten, obwohl sie der Verschönerung dienen. So sind Mittel, die eingenommen, eingeatmet, eingespritzt oder in den menschlichen Körper eingepflanzt werden, keine kosmetischen Mittel sowie Mittel, die eine überwiegende andere Zweckbestimmung haben, z.B. Mittel, die überwiegend als Insektenschutz dienen. Auch Mittel zur Pflege von Tieren sind keine Kosmetikprodukte gemäß der Kosmetik-Verordnung (EG) Nr. 1223/2009.
Nähere Informationen zum Thema Abgrenzung von Kosmetika zu Arzneimitteln und Medizinprodukten:
Personen, die ein Produkt in Verkehr bringen möchten, können gemäß § 1 Abs 3b Arzneimittelgesetz (AMG) beim Bundesamt für Sicherheit im Gesundheitswesen (BASG) einen Antrag stellen, auf Feststellung, ob dieses Produkt unter die Definition des Arzneimittels fällt. Das BASG führt auch Abgrenzungen von Medizinprodukten ausschließlich basierend auf § 5a des österreichischen Medizinproduktegesetzes (BGBl. 657/1996 idgF., MPG) durch. Diese Aufträge sind gebührenpflichtig. Die jeweiligen Formulare und Details finden Sie hier.
Kriterien für die Abgrenzung
Wichtige Kriterien für die Abgrenzung finden Sie in erster Linie in den Entscheidungen des europäischen Gerichtshofs (EuGH).
Die Europäische Kommission hat einen Leitfaden zu Grenzprodukten bei kosmetischen Mitteln veröffentlicht, der gemeinsam mit den Mitgliedstaaten erarbeitet wurde und auf unterschiedliche Produkte eingeht. Dieser wird regelmäßig aktualisiert: Borderline products manual on the scope of application of the Cosmetics Regulation (EC) No 1223/2009 (Art. 2(1)(a)) (November 2024, Version 5.4)
Zur Abgrenzung von Handreinigern und Handdesinfektionsmitteln gibt es zwei Dokumente
- Guidance on the applicable legislation for leave-on hand cleaners and hand disinfectants
- Borderline working document on leave-on hand gels November 2020 (available in 23 EU languages)
Weitere Guidance Documents on "Borderlines" finden Sie hier.
Naturkosmetik & Bio-Kosmetik
Umweltschonende nachhaltige Produktion, Bewahrung der Artenvielfalt, Schutz der natürlichen Ressourcen, Anwendung von hohen Tierschutzstandards, Produktion unter Verwendung natürlicher Bestandteile und einfache Herstellungsprozesse werden von Verbraucherinnen und Verbrauchern zunehmend auch bei kosmetischen Mitteln nachgefragt. Um die Interessen und das Vertrauen der Verbraucherinnen und Verbraucher zu wahren und einen lauteren Wettbewerb durch Transparenz, Kontrolle und Rückverfolgbarkeit zu gewährleisten, war es daher angebracht, Grundsätze und Regeln für die Herstellung und Kennzeichnung von "Bio- sowie Naturkosmetika" zu formulieren.
Auf europäischer Ebene gibt es keine einheitlichen, gesetzlichen Definitionen zu den Begriffen Naturkosmetik und Bio-Kosmetik. Es gibt diverse Naturkosmetik- und Bio-Gütesiegel, die auf privatrechtlichen Richtlinien basieren. Die dabei zugrundeliegenden Kriterien sind unterschiedlich, sodass diese Produkte keine einheitliche Norm erfüllen. Diese Situation ist sowohl für Konsumentinnen und Konsumenten als auch für Hersteller unübersichtlich.
Naturkosmetik
In Österreich ist im Österreichischen Lebensmittelbuch ÖLMB (Codex Alimentarius Austriacus, kurz: Codex) zusammengefasst, was sich die Konsumentin oder der Konsument unter Naturkosmetik erwartet bzw. was die allgemeine Verkehrsauffassung betrifft.
Seit 2008 steht dieses Codexkapitel über Naturkosmetik zur Verfügung und wird, wenn nötig, von der Kosmetikunterkommission überarbeitet, um der Erwartung von Verbraucherinnen und Verbrauchern zu entsprechen. Am 6.2.2017 wurde Dehydracetsäure als zulässiges Konservierungsmittel mit aufgenommen. Den Volltext finden Sie unter Codexkapitel B 33 Kosmetische Mittel, Teilkapitel: Naturkosmetik.
Bio-Kosmetik
Biokosmetik, geregelt im EU-Qualitätsregelungen- Durchführungsgesetz (EU-QuaDG), BGBl. I Nr. 130/2015 und der entsprechenden Richtlinie, welche seit 1.12.2017 gültig ist und das Codexkapitel A8 Abschnitt 6 Biokosmetik ersetzt.
Mit Inkrafttreten des EU-Qualitätsregelungen-Durchführungsgesetzes (EU-QuaDG) wurde der Inhalt des Codex-Kapitels A 8 „Landwirtschaftliche Produkte aus biologischer Produktion und daraus hergestellte Folgeprodukte" in die vom Beirat für die biologische Produktion erarbeitete Richtlinie gemäß § 13 des EU-Qualitätsregelungen-Durchführungsgesetzes (EU-QuaDG), BGBl. I Nr. 130/2015, übernommen. Der Richtlinie - Landwirtschaftliche Produkte aus biologischer Produktion und daraus hergestellte Folgeprodukte (RL Biologische Produktion) kommt, wie schon beim österreichischen Lebensmittelbuch, die Wirkung eines objektivierten Sachverständigengutachtens zu.
Kennzeichnung und Werbung für kosmetische Mittel, die nach den Vorgaben dieses Abschnittes erzeugt wurden, enthalten einen eindeutigen Hinweis auf die Erzeugung entsprechend dieser Richtlinie (hergestellt gemäß Richtlinie des Beirates für die biologische Produktion „Biologische Produktion, Abschnitt Biokosmetika“).
Kosmetikunternehmen, die ihre Produkte als Biokosmetika in Verkehr bringen, haben ihre Tätigkeit durch eine für die biologische Produktion nach der Verordnung (EG) Nr. 834/2007 bereits anerkannte Biokontrollstelle kontrollieren zu lassen. Die Angabe der Kontrollstelle ist erforderlich und das Kontrollstellen-Siegel darf angebracht werden, das Bio-Gemeinschaftslogo jedoch nicht, da die EU-Bioverordnung nicht für kosmetische Mittel gilt.
Die natürlichen Inhaltsstoffe in Biokosmetika werden unterschieden in natürliche Stoffe landwirtschaftlichen Ursprungs (pflanzliche und tierische Produkte) und in jene nicht landwirtschaftlichen Ursprungs (mineralische Rohstoffe und Wasser).
Pflanzliche und tierische Bestandteile landwirtschaftlichen Ursprungs, müssen zumindest zu 95 % den Bestimmungen über die biologische/ökologische Produktion entsprechen (Verordnung (EG) Nr. 834/2007 samt Durchführungsverordnungen). Zusätzlich muss ein biologischer Mindestanteil bezogen auf das Endprodukt vorhanden sein (siehe untenstehende Tabelle). Dies soll einer ungerechtfertigten Bio-Anpreisung, etwa im Falle einer wässrigen Lösung mit einer „homöopathischen“ Menge eines Rohstoffs in Bioqualität, entgegenwirken.
| Kategorie | Biologischer Mindestbestandteil in % bezogen auf das Fertigprodukt |
|---|---|
| Öle/wasserfreie Reinigungs- und Pflegeprodukte | 90 |
| Parfums/Eau de Parfum/Eau de Toilette | 60 |
| Emulsionen zur Hautpflege (W/Ö) | 30 |
| Produkte mit einem Mineralstoffgehalt größer 80 % | 10 |
| Andere Produkte | 20 |
Tabelle: Biologische Mindestanteile in Biokosmetika
Weiters wurden Regeln festgelegt, bis zu welchem Anteil wässrige Gemische wie Destillate, Extrakte, Hydrolate oder auch rückverdünnte Konzentrate zur Berechnung des Bioanteils herangezogen werden dürfen. Es sollen nur die tatsächlich aus Pflanzen gewonnenen Anteile dem Bioanteil zugerechnet werden können.
Gleich wie bei den Naturkosmetikprodukten dürfen nur natürliche Riech- und Aromastoffe, die der internationalen Norm ISO 9235 entsprechen sowie die darin aufgeführten Stoffe, die durch physikalische Methoden isoliert wurden, eingesetzt werden. Die erlaubten naturidenten Konservierungsstoffe sind auch jene, die in Naturkosmetika eingesetzt werden dürfen. Eine Liste zu den naturidenten Konservierungsstoffen finden Sie unter Codexkapitel B 33 Kosmetische Mittel, Teilkapitel: Naturkosmetik.
Den Volltext der Richtlinie finden Sie unter: Richtlinie - Landwirtschaftliche Produkte aus biologischer Produktion und daraus hergestellte Folgeprodukte (RL Biologische Produktion) (Abschnitt 6 Biokosmetik).
Unerwünschte Wirkungen
In Artikel 2 der Verordnung (EG) Nr. 1223/2009 werden folgende Begriffe definiert:
Eine unerwünschte Wirkung ist eine negative Auswirkung auf die menschliche Gesundheit, die auf den normalen oder vernünftigerweise vorhersehbaren Gebrauch eines kosmetischen Mittels zurückführbar ist.
Eine ernste unerwünschte Wirkung ist eine unerwünschte Wirkung, die zu vorübergehender oder dauerhafter Funktionseinschränkung, Behinderung, einem Krankenhausaufenthalt, angeborenen Anomalien, unmittelbarer Lebensgefahr oder zum Tod führt.
Gemäß Artikel 23 müssen die verantwortliche Person, die Händlerinnen und Händler das Auftreten ernster unerwünschter Wirkungen unverzüglich der zuständigen Behörde melden. Auch für Verbraucherinnen/Verbraucher und Ärztinnen/Ärzten gibt es die Möglichkeit ernste unerwünschte Wirkungen zu melden.
| Meldeformulare | für wen? | Meldung an |
|---|---|---|
| Meldeformular A | verantwortliche Person und den Händler | zuständige Behörde |
| Mitteilungsformular AT | Verbraucherinnen/Verbraucher und Ärztinnen/Ärzte | zuständige Lebensmittelaufsichtsbehörde |
Jedem Formular ist eine Ausfüllanleitung beigefügt. Das übermittelte Formular ist sowohl für die Erstmeldung als auch für Aktualisierungen (Follow-Up, abschließende Schlussfolgerung) heranzuziehen.
In der Leitlinie für die Meldung von ernsten unerwünschten Wirkungen wird genau beschrieben, wie vorzugehen und die Kausalitätsbewertung durchzuführen ist. Ernste unerwünschte Wirkungen und unerwünschte Wirkungen sind außerdem in der Sicherheitsinformation und Produktinformationsdatei (siehe Sicherheitsbewertung von kosmetischen Mitteln) anzugeben (Artikel 11).
Weiters gewährleistet die verantwortliche Person, dass vorhandene Daten über unerwünschte Wirkungen und schwere unerwünschte Wirkungen, die durch das kosmetische Mittel bei seiner Anwendung hervorgerufen werden, der Öffentlichkeit mit geeigneten Mitteln leicht zugänglich gemacht werden (Artikel 21)
Auf der Homepage des Sozialministeriums finden Sie detailliertere Informationen zu dem Meldesystem von ernsten unerwünschten Wirkungen sowie den Kontaktstellen der jeweiligen Lebensmittelaufsicht in Ihrem Bundesland.
Weitere Informationen zu ernsten unerwünschten Wirkungen (Serious Undesirable Effects - SUE) finden Sie auf der Seite der Europäischen Kommission zu Kosmetika.
Weiterführende Informationen
- Bundesamt für Verbraucherschutz und Lebensmittelsicherheit
- Bundesinstitut für Risikobewertung BfR
- Chemische und Veterinäruntersuchungsämter CVUA
- Deutsche Gesellschaft für Wissenschaftliche und Angewandte Kosmetik DGK (siehe Fachgruppen)
- Gesellschaft Deutscher Chemiker GDCh: Arbeitsgruppe Kosmetische Mittel (siehe "Datenblätter zur Bewertung der Wirksamkeit von Wirkstoffen in kosmetischen Mitteln")
- Deutscher Industrieverband Körperpflege und Waschmittel IKW: Schönheitspflege
- Leitlinie zur Handhabung von unerwünschten Wirkungen und zur Meldung von ernsten unerwünschten Wirkungen innerhalb der Europäischen Union (Cosmetics Europe/IKW 2013)
- Colipa-Leitlinien zu den Anforderungen an die Produktinformationsdatei - PID (Cosmetics Europe/IKW 2013)
- Colipa-Leitfaden: Verantwortlichkeiten innerhalb der Lieferkette (Cosmetics Europe/IKW 2013)
- Colipa-Leitlinien für die Kennzeichnung von kosmetischen Mitteln (Cosmetics Europe/IKW 2013)
- Datenbank der Europäischen Kommission: CosIng
(schnelle, übersichtliche Suche nach kosmetischen Inhaltsstoffen) - Europäische Kommission: Kosmetische Mittel
- Europäische Kosmetikverordnung (Verordnung (EG) Nr. 1223/2009 - konsolidierte Fassung)
- Europäischer Kosmetikverband – Cosmetics Europe
- IFRA – Internationaler Riechstoffverband
- RAPEX-Notifizierungen
- Scientific Committee on Consumer Safety (SCCS) - wissenschaftlicher Kosmetikausschuss, Mandate und Stellungnahmen (SCS-Opinions 2016-2021)
Downloads
Kontakt
Aktualisiert: 01.04.2025